ORBITAL DAN PERANANNYA DALAM IKATAN KOVALEN
- Dapatkan link
- X
- Aplikasi Lainnya
A. ORBITAL HIBRIDA dari NITROGEN DAN OKSIGEN
1.
Atom Nitrogen
Ikatan
kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentuk
oleh atom-atrom lain. Semua ikatan kovalen yang dibentuk oleh unsur-unsur dalam
tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan
hibrida sama dengan pada atom karbon. Amonia, NH3, salah satu contoh molekul
yang mengandung ikatan kovalen yang melibatkan atom nitrogen. Atom nitrogen memiliki
konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom
nitrogen berikatan dengan tiga atom hidrogen.
Ketika
terdapat tiga elektron tak berpasangan mengisi orbital 2p, ini memungkinkan
orbital 1s dari hidrogen untuk overlap dengan orbital 2p tersebut membentuk
ikatan sigma. Sudut ikatan yang terbentuk adalah 107.30, mendekati sudut
tetrahedral (109.50). Nitrogen memiliki lima elektron pada kulit terluarnya.
Pada hibridisasi sp3, satu orbital
sp3
diisi oleh dua
elektron dan tiga orbital sp3 diisi masing masing satu elektron.
Ikatan sigma terbentuk dari overlap orbital hibrida
sp3 yang tidak berpasangan tersebut dengan orbital 1s dari hydrogen menghasilkan
molekul ammonia. Dengan demikian, ammonia memiliki bentuk geometri tetrahedral
yang mirip dengan metana. Ikatan N-H memiliki panjang 1.01 A dan kekuatan
ikatan 103 kkal/mol.
Nitrogen memiliki tiga elektron tak berpasangan pada
orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut tereksitasi
ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron pada orbital p
digunakan untuk membentuk ikatan pi. Jadi, atom nitrogen yang terhibridisasi
sp2 memiliki satu ikatan pi yang digunakan untuk membentuk ikatan rangkap dua,
mirip dengan molekul etena. Apabila elektron yang tereksitasi ke orbital p ada
dua maka nitrogen memiliki kemampuan membentuk dua ikatan pi atau satu ikatan
rangkap tiga (hibridisasi sp).
3. Atom Oksigen
Elektron pada
ground-state atom oksigen memiliki konfigurasi: 1s2 2s2 2px2 2py1 2pz1, dan
oksigen merupakan atom divalen.
Dengan
melihat konfigurasi elektronnya, dapat diprediksi bahwa oksigen mampu membentuk
dua ikatan sigma karena pada kulit terluarnya terdapat dua elektron tak
berpasangan (2py dan 2pz).
Air adalah contoh senyawa yang mengandung oksigen
sp3. sudut ikatan yang terbentuk sebesar 104.50. diperkirakan bahwa orbital dengan
pasangan elektron bebas menekan sudut ikatan H-O-H, sehingga sudut yang
terbentuk Dalam kondisi ini, oksigen hanya memiliki satu ikatan sigma, tetapi juga
memilki satu ikatan pi. Contoh molekul yang memiliki atom oksigen
terhibridisasi sp2 adalah pada senyawa-senyawa karbonil.
Satu contoh terakhir dari hibridisasi orbital yang
sering ditemukan adalah boron trifluorida, BF3. Boron hanya memiliki tiga elektron
di kulit terluarnya (1s2 2s2 2px1), hal ini berarti bahwa boron hanya dapat
membentuk paling banyak tiga ikatan. Kita dapat mempromosikan elektron pada
orbital 2s ke orbital 2py, akan tetapi tidak mungkin melengkapi boron dengan
elektron oktet.
terdapat satu orbital p (2pz) yang kosong. Molekul
BF3 yang terbentuk memiliki geometri planar, sehingga dapat dikatakan bahwa
boron terhibridisasi sp2.
lebih kecil dari
sudut ideal (109.50), seperti halnya pasangan elektron bebas dalam ammonia
menekan sudut ikatan H-N-H. Oksigen juga dapat terhibridisasi sp2, yaitu dengan
mempromosikan satu elektronnya ke orbital p.
B. IKATAN RANGKAP TERKONJUGASI
Membahas mengenai orbital hibrida
Nitrogen dan oksigen, selaknya kita perlu tahu apa yang dimaksud dengan
hibridisasi. Hibridisasi adalah konsep pencampuran orbital atom menjadi
orbital hibrida yang sesuia dengan pasangan elektron untuk membentuk
ikatan kimia. Orbital hibrida biasanya mempunyai perbedaan energi dan
bentuk. Hibridisasi berguna untuk menjelaskan struktur molekuler ketika
teori ikatan valensi gagal untuk menjelaskan.
Beberapa tipe hibridisasi :
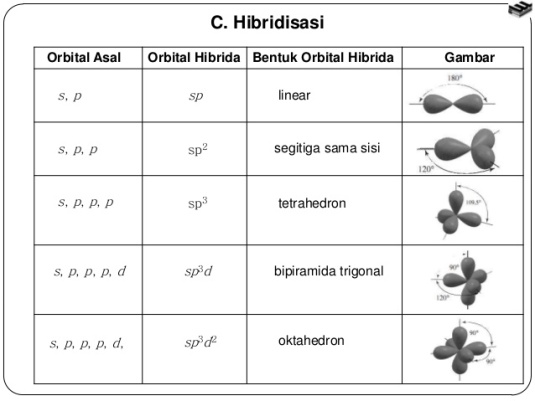
Yang akan kita bahas hanya tiga tipe yakni hibridisasi sp,sp2,dan sp3.
Hibridisasi sp
Hibridisasi sp dapat digunakan untuk menjelaskan molekul linier. Orbital 2s dan satu orbital 2p melakukan hibridisasi membentuk dua orbital sp, masing-masing terdiri dari 50% karakter p dan 50% karakter s. Misalnya alkuna yang mempunyai ikatan rangkap tiga.
Hibridisasi sp2
Hibridisasi sp2 digunakan untuk menjelaskan bentuk struktur molekul trigonal planar. Orbital 2s dan orbital 2p melakukan hibridisasi membentuk tiga orbital sp, masig-masing terdiri dari 67% karakter p dan 33% karakter s . Cuping depan mensejajarkan diri membentuk trigonal planar, menghadap sudut segitiga untuk meminimalisasi penolakan electron. Misalnya etilena (C2H4) yang memiiki iktan rangkap dua.
Hibridisasi sp3
Hibridisasi sp berguna untuk menjelaskan struktur tetrahedral, orbital 2s dan tiga orbital 2p melakukan hibridisasi untuk membentuk empat orbital sp. Masing-masing terdiri dari 75% karakter p dan 25% karakter s. cuping depan mnsejajarkan diri dan penolakan electron bersifat lemah. Contohya metana (CH4)
Jika dibandingkan kestabilan ikatan C-C dengan ikatan C-O, ikatan antar atom C-O lebih kuat dan stabil dikarenakan jumlah elektron atom O yang di sumbangkan lebih banyak dari pada atom C yang hanya berjumlah 4 elektron yang mengakibatkan keelektronegatifan dan afinitas elektron iktan atom C-O lebih dibandingkan ikatan antar atom C-C.
Isomer geometri Cis dan Trans
Isomer geometri terbagi menjadi dua yakni Cis dan Trans. Bila subtituen terletak pada bidang yang sama maka disebut cis, sedangkan trans bila subtituen terletak pada bidang yang bersebrangan. Struktur trans lebih stabil dibandingkan dengan cis karena makin besar halangan sterik maka energinya makin besar inilah yang terjadi pada struktur cis.
Contohnya cis-2-butena dan trans-2-butena

Cis-2-butena lebih labil dibandingkan dengan trans-2-butena, sifat fisisnya pun berbeda, titik didih pada struktur trans ini lebih rendah dibandingkan dengan struktur cis karena kerapatan atau kebolehjadian menemukan elektron cis-2-butena yang lebih tinggi dibandingkan trans-2-butena. Sedangkan titik lebur cis-2-butena lebih rendah dari pada trans-2-butena, sehingga cis-2-butena lebih cepat melebur karena halangan steriknya lebih besar.
Resonansi adalah delokalisasi elektron pada molekul atau ion poli atomic tertentu dimana ikatannya tidak dapat dituliskan dalam satu truktur Lewis. Struktur molekul atau ion yang mempunyai delokalisasi elektron disebut dengan struktur resonan. Dan ini telah menjelaskan bahwa mengapa benzene sulit untuk di lakukan pemutusan ikatannya.
Namun jika direaksikan dengan katalis asaw Lewis (acceptor proton) maka benzene dapat di brominasi. Adalah FeBr3 katalis dari teori asam Lewis yang dapat membantu Br masuk kedalam ikatan benzene . Hal ini dikarenakan Fe dapat menyerap elektron ikatan pada benzene. Subtittuen yang terdapat dalam rantai siklo benzene dapat digolongkan sebagai pengarah orto, para, dan meta.
Mekanisme Pengarah Orto, Para, Dan Meta
Benzena yang mulanya telah tersubtitusi dapat mengalami subtitsi kedua dan menghasilkan disubtitusi benzene. Dari struktur subtitusi pertama ini dapat menentukan tempat dari subtitusi keduanya. Misalkan saja, dalam TNT (trinitrotoluene) pada cincin benzena terdapat suatu gugus metil yang mengarahkan subtitusi ke wilayah orto atau para. Sedangkan gugus nitro dapat mengarahkan subtitusi ke wilayah meta. Semua pengarah orto dan para merupakan pendonor elektron, yang dapat terjadi Karen resonansi maupun induksi. Pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena.
C. BENZENA DAN RESONANSI



Beberapa tipe hibridisasi :

Yang akan kita bahas hanya tiga tipe yakni hibridisasi sp,sp2,dan sp3.
Hibridisasi sp
Hibridisasi sp dapat digunakan untuk menjelaskan molekul linier. Orbital 2s dan satu orbital 2p melakukan hibridisasi membentuk dua orbital sp, masing-masing terdiri dari 50% karakter p dan 50% karakter s. Misalnya alkuna yang mempunyai ikatan rangkap tiga.
Hibridisasi sp2
Hibridisasi sp2 digunakan untuk menjelaskan bentuk struktur molekul trigonal planar. Orbital 2s dan orbital 2p melakukan hibridisasi membentuk tiga orbital sp, masig-masing terdiri dari 67% karakter p dan 33% karakter s . Cuping depan mensejajarkan diri membentuk trigonal planar, menghadap sudut segitiga untuk meminimalisasi penolakan electron. Misalnya etilena (C2H4) yang memiiki iktan rangkap dua.
Hibridisasi sp3
Hibridisasi sp berguna untuk menjelaskan struktur tetrahedral, orbital 2s dan tiga orbital 2p melakukan hibridisasi untuk membentuk empat orbital sp. Masing-masing terdiri dari 75% karakter p dan 25% karakter s. cuping depan mnsejajarkan diri dan penolakan electron bersifat lemah. Contohya metana (CH4)
Ikatan rangkap terkonjugasi
Ikatan rangka terkonjugasi merupakan ikatan antar atom karbon atau yang terjadi pada senyawa organic yang secara kovale ikatan atar atomnya merupakan ikatan rangkap dua dan tunggal bergantian, dimana terjadinya delokalisasi electron agar tingakt energinya lebih stabil atau bias disebut dengan stabilisasi struktur.Jika dibandingkan kestabilan ikatan C-C dengan ikatan C-O, ikatan antar atom C-O lebih kuat dan stabil dikarenakan jumlah elektron atom O yang di sumbangkan lebih banyak dari pada atom C yang hanya berjumlah 4 elektron yang mengakibatkan keelektronegatifan dan afinitas elektron iktan atom C-O lebih dibandingkan ikatan antar atom C-C.
Isomer geometri Cis dan Trans
Isomer geometri terbagi menjadi dua yakni Cis dan Trans. Bila subtituen terletak pada bidang yang sama maka disebut cis, sedangkan trans bila subtituen terletak pada bidang yang bersebrangan. Struktur trans lebih stabil dibandingkan dengan cis karena makin besar halangan sterik maka energinya makin besar inilah yang terjadi pada struktur cis.
Contohnya cis-2-butena dan trans-2-butena

Cis-2-butena lebih labil dibandingkan dengan trans-2-butena, sifat fisisnya pun berbeda, titik didih pada struktur trans ini lebih rendah dibandingkan dengan struktur cis karena kerapatan atau kebolehjadian menemukan elektron cis-2-butena yang lebih tinggi dibandingkan trans-2-butena. Sedangkan titik lebur cis-2-butena lebih rendah dari pada trans-2-butena, sehingga cis-2-butena lebih cepat melebur karena halangan steriknya lebih besar.
Benzena dan resonansi
Benzena termasuk senyawa aromatic yang merupakan senyawa siklik(rantai lingar) yang elektronya terkonjugasi. Jika satu atom H diambil atau dikurangi dari rumus molekul C6H6 akan menghasilkan suatu radikal fenil C6H5 yang disebut aril disingkat Ar. Benzena tidak dapat dibrominasi atau dilakukan pemutusan ikatan karena rantai sikliknya maka jika terjadi tanda-tanda pemutusan ikatan dapat distabilkan oleh ikatan pi (π) disebelahnya. Hal ini berhubungan dengan resonansi benzena.Resonansi adalah delokalisasi elektron pada molekul atau ion poli atomic tertentu dimana ikatannya tidak dapat dituliskan dalam satu truktur Lewis. Struktur molekul atau ion yang mempunyai delokalisasi elektron disebut dengan struktur resonan. Dan ini telah menjelaskan bahwa mengapa benzene sulit untuk di lakukan pemutusan ikatannya.
Namun jika direaksikan dengan katalis asaw Lewis (acceptor proton) maka benzene dapat di brominasi. Adalah FeBr3 katalis dari teori asam Lewis yang dapat membantu Br masuk kedalam ikatan benzene . Hal ini dikarenakan Fe dapat menyerap elektron ikatan pada benzene. Subtittuen yang terdapat dalam rantai siklo benzene dapat digolongkan sebagai pengarah orto, para, dan meta.
Mekanisme Pengarah Orto, Para, Dan Meta
Benzena yang mulanya telah tersubtitusi dapat mengalami subtitsi kedua dan menghasilkan disubtitusi benzene. Dari struktur subtitusi pertama ini dapat menentukan tempat dari subtitusi keduanya. Misalkan saja, dalam TNT (trinitrotoluene) pada cincin benzena terdapat suatu gugus metil yang mengarahkan subtitusi ke wilayah orto atau para. Sedangkan gugus nitro dapat mengarahkan subtitusi ke wilayah meta. Semua pengarah orto dan para merupakan pendonor elektron, yang dapat terjadi Karen resonansi maupun induksi. Pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena.
C. BENZENA DAN RESONANSI
Senyawa benzena mempunyai rumus molekul C6H6,
dan termasuk dalam golongan senyawa hidrokarbon aromatik. Nama aromatik
digunakan karena senyawa tersebut berbau harum.dari rumus molekulnya dapat
diketahui bahwa benzena merupakan senyawa tidak jenuh karena tidak memenuhi
rumus CnH2n+2.Bila dibandingkan dengan senyawa hidrokarbon lain yang mengandung
6 buah atom karbon, misalnya heksana (C6H14) dan sikloheksana (C6H12), maka
dapat diduga bahwa benzena mempunyai derajat ketidakjenuhan yang tinggi. Dengan
dasar dugaan tersebut maka dapat diperkirakan bahwa benzena memiliki ciri-ciri
khas seperti yang dimiliki oleh alkena.Perkiraan tersebut ternyata jauh berbeda
dengan kenyataannya, karena benzena tidak dapat bereaksi seperti alkena (adisi,
oksidasi, dan reduksi).Lebih khusus lagi benzena tidak dapat bereaksi dengan
HBr, dan pereaksi-pereaksi lain yang lazimnya dapat bereaksi dengan
alkena.Sifat-sifat kimia yang diperlihatkan oleh benzena memberi petunjuk bahwa
senyawa tersebut memang tidak segolongan dengan alkena ataupun sikloalkena.
Senyawa benzena dan sejumlah turunannya
digolongkan dalam senyawa aromatik, Penggolongan ini dahulu semata-mata
dilandasi oleh aroma yang dimiliki sebagian dari senyawa-senyawa
tersebut.Perkembangan kimia pada tahap berikutnya menyadarkan para kimiawan
bahwa klasifikasi senyawa kimia haruslah berdasarkan struktur dan
kereaktifannya, dan bukan atas dasar sifat fisikanya.Saat ini istilah aromatik
masih dipertahankan, tetapi mengacu pada fakta bahwa semua senyawa aromatik
derajat ketidakjenuhannya tinggi dan stabil bila berhadapan dengan pereaksi
yang menyerang ikatan pi (π).
Benzena tidak dapat dibrominasi atau dilakukan
pemutusan ikatan karena rantai sikliknya maka jika terjadi tanda-tanda
pemutusan ikatan dapat distabilkan oleh ikatan pi (π) disebelahnya. Hal ini
berhubungan dengan resonansi benzena. Resonansi
adalah delokalisasi elektron pada molekul atau ion poli atomic tertentu dimana
ikatannya tidak dapat dituliskan dalam satu truktur Lewis. Struktur molekul
atau ion yang mempunyai delokalisasi elektron disebut dengan struktur resonan.
Dan ini telah menjelaskan bahwa mengapa benzene sulit untuk di lakukan
pemutusan ikatannya. Namun jika
direaksikan dengan katalis asaw Lewis (acceptor proton) maka benzene dapat di
brominasi. Adalah FeBr3 katalis dari teori asam Lewis yang dapat membantu Br
masuk kedalam ikatan benzene . Hal ini dikarenakan Fe dapat menyerap elektron
ikatan pada benzene. Subtittuen yang terdapat dalam rantai siklo benzene dapat
digolongkan sebagai pengarah orto, para, dan meta.
MEKANISME PENGARAH ORTO, PARA DAN GUGUS
PENGARAH META
Gugus-gugus yang meningkatkan laju
reaksi dinamakan gugus pengaktif sedangkan gugus yang memperlambat laju
reaksi disebut gugus pendeaktif. Gugus-gugus yang termasuk kelompok
pengarah orto-para sebagian bersifat pengaktif dan sebagian lainnya bersifat pendeaktif,
sedangkan gugus-gugus pengarah meta semuanya termasuk dalam kelompok pendeaktif.
Jika suatu gugus dikatakan sebagai pengaruh orto-para tidak mutlak diartikan
bahwa gugus yang baru seluruhnya diarahkan keposisi orto dan para
Halogen
termasuk kelompok gugus pengarah orto-para, tetapi gugus ini mendeaktifkan
inti. Kekhususan pada halogen ini dapat dijelaskan dengan asumsi bahwa efek
induksinya mempengaruhi kereaktifan dan efek resonansinya menentukan orientasi.
Pada senyawa klorobenzena, karena atom klor sangat elektronegatif maka
diperkirakan terjadi penarikan elektron pada inti benzena dan karena itu
mendeaktifkan inti benzena dalam reaksi subtitusi elektrofilik.
1.
Gugus Pengarah
Orto, Para
Kita lihat nitrasi pada toluena. Pada langkah
pertama ion nitrium dapat meyerang karbon cincin yang posisinya orto, meta atau
para terhadap gugus metil.
Pada salah satu dari ketiga penyumbang
resinansi pada ion Benzenonium antara (intermedia) untuk subsitusi orto atau
para, muatan positip berada pada karbon pembawa metil. Penyumbang resonansi itu
ialah karbo kation tersier dan lebih stabil dari pada penyumbang lainnya yang
merupakan karbo kation sekunder. Sebaliknya, dengan serangan meta, semua
penyumbang adalah karbo kation sekunder; muatan positif pada ion Benzenonium
intermediet tidak pernah bersebelahan dengan subsituen metil. Dengan demikian,
gugus metil ialah pengarah orto, para, karna pereaksi ini dapat berlangsung
melalui karbo kation intermediet yang paling stabil. Sama halnya, semua gugus
alkil lainnya ialah pengarah orto, para.
Sekarang kita liat gugus pengarah orto, para
yang tertera pada tabel 4.1. pada setiap gugus tersebut, atom yang melekat pada
cincin aromatik memiliki pasangan elektron bebas.
Pasangan elektron bebas ini dapat menstabilkan
muatan positif di sebelahnya. Mari kita lihat contoh, yaitu Brominasi fenol.
Baik dalam hal serangan orto atau para, salah
satu penyumbang pada ion benzenonium intermediet menempatkan muatan positif
pada karbon pembawa hidroksil. Pergeseran pasangan elektron bebas dari oksigen
ke karbon positif menyebabkan muatan positif terdelokalisasi lebih jauh, yaitu
ke oksigen (lihat struktur dalam kotak biru). Tidak mungkin ada struktur
seperti ini pada serangan meta. Dengan begitu, gugus hidroksil ialah pengarah
orto,para.
Kita dapat menggeneralisasi pengamatan ini. Semua
gugus dengan elektron bebas pada atom yang melekat pada cincin ialah pengarah
orto, para.
2.
Gugus Pengarah
Meta
Sekarang mari kita periks nitrasi pada Nitro
benzena dengan cara yang sama, untuk melihat apakah kita dapat menjelaskan efek
pengarah meta dari gugus nitro. Pada nitro benzena, nitrogen memiliki muatan
formal +1, sebagaiman ditunjukan pada strukturnya. Persamaan untuk membentuk ion
benzenonium intermediet ialah
Pada persamaan 4.30, salah satu penyumbang
pada hibrid resonansi intermediet untuk subsitusi orto atau para memiliki dua
muatan positif yang bersebelahan, yaitu susunan yang sangat tidak diinginkan,
sebab muatan yang sama saling tolak menolak. Tidak ada intermediet seperti ini
pada substitusi meta (persamaan 4.31). karna alasan inilah, subsitusi meta
lebih disukai.
Dapatkah kita menggeneralisasi penjelasan ini
pada gugus pengarah meta lainnya pada tabel 4.1? perhatikan bahwa setiap gugus
pengarah meta dihubungkan ke cincin aromatik oleh suatu atom yang merupakan
bagian dari ikatan rangkap atau ikatan rangkap tiga, dengan ujung lainnya ialah
atom yang lebih elektronegatif daripada karbon ( contohnya, atom
oksigen/nitrogen). Dalam hal ini atom yyang melekat pada cincin benzena akan
membawa muatan positif parsial (seperti nitrogen pada gugus nitro). Ini karena
penyumbang resonansi, seperti semua gugus yang serupa itu akan menjadi pengarah
meta karena alasan yang sama sepertingugus nitro yang bersifat pengarah meta:
untuk mengindari adanya dua muatan positif yang bersebelahan dalam ion
benzenonium intermedietnya. Kita dapat membuat generalisasi. Semua gugus dengan
atom yang langsung melekat pada cincin aromatik yang bermuatan positif atom
merupakan bagian ikatan majemuk dengan unsur yang lebih elektronegatif ialah
pengarah meta.
Permasalahan: bagaimana dan apa yang menyebabkan benzena yang mulanya telah tersubstitusi dapat mengalami substitusi kedua dan menghasilkan substitusi benzena?
Permasalahan: bagaimana dan apa yang menyebabkan benzena yang mulanya telah tersubstitusi dapat mengalami substitusi kedua dan menghasilkan substitusi benzena?
DAFTAR PUSTAKA
- sriwahyunioktavia05.blogpot.co.id/2016/09/benzena-dan-resonansi-gugus
- ulthawindaraekawardanni.wordpress.com/2016/09/hibridisasi-orb
- robys1997.blogspot.co.id/2016/09/orbital-hibrida-dari-nitrogen-dan html
- Dapatkan link
- X
- Aplikasi Lainnya




Assalmualaikum saya ingin menambahkan sedikit mengenai teori hibridisasi:
BalasHapusBerdasarkan mekanika kuantum transisi elektronik yang dibolehkan atau tidak dibolehkan (terlarang) disebut kaidah seleksi. Berdasarkan kaidah seleksi, suatu transisi elektronik termasuk:
1. Transisi diperbolehkan bila nilai ε sebesar 103 sampai 106.
2. Transisi terlarang bila nilai ε sebesar 10-3 sampai 103
terimakasih karlina sudah menambahkan kekurangan postingan saya
Hapusmengapa Struktur trans lebih stabil dibandingkan dengan cis?
BalasHapusTerdapat dua bentuk isomer cis-trans, yakni cis dan trans. Ketika gugus substituen berorientasi pada arah yang sama, diastereomer ini disebut sebagai cis, sedangkan ketika subtituen berorientasi pada arah yang berlawanan, diastereomer ini disebut sebagai trans. Contoh molekul hidrokarbon yang menunjukkan isomerisme cis-trans adalah 2-butena.
HapusApa hungannya pengarah orto, para dan gugus pengarah meta dalam ikatan benzena nitrogen ?
BalasHapushubungannya adalah laju reaksi bergantung pada serangan elektrofilik pada cincin aromatik, maka substituen yang bersifat pendonasi elektron ke cincin akan meningkatkan rapatan elektronnya, dan dengan demikian mempercepat reaksi, substituen yang bersifat menarik elektron dari cincin akan menurunkan rapatan elektron dalam cincin dan dengan begitu memperlambat reaksi. Pola relativitas ini tepat seperti yang teramati, tidak saja dengan nitrasi tetapi juga dengan semua reaksi substitusi aromatik elektrofilik.
HapusDisamping perbedaan laju dalam reaksi benzena tersubstitusi, posisi serangan juga berbeda
Mengapa Orbital molekul anti ikatan memiliki energi yg lebih tinggi dan kestabilan yang lebih rendah dibandingkan orbital-orbital atom pembentuknya?
BalasHapusBalas
karena Menurut teori orbital molekul, orbital molekul dihasilkan dari interaksi antara dua atau lebih orbital atom. Terjadinya tumpang tidih suatu orbital mengarah pada pembentukan dua orbital atom : satu orbital molekul ikatan dan satu orbital molekul antiikatan. Orbital molekul ikatan (bonding molecular orbital) memiliki energi yang lebih rendah dan kestabilan yang lebih besar dibandingkan dengan orbital atom pembentuknya. Orbital molekul antiikatan (antibonding molecular orbital) memiliki energi yang lebih tinggi dan kestabilan yang lebih rendah dibandingkan dengan orbital-orbital atom pembentuknya.
HapusSelamat malam indah.
BalasHapusSetelah membaca postingan anda, saya ingin bertanya. tolong jelaskan bagaimana proses resonasi pada benzene? Terimakasih.
HapusBerdasarkan hasil analisis sinar-X maka diusulkan bahwa ikatan rangkap pada molekul benzena tidak terlokalisasi pada karbon tertentu melainkan dapat berpindah-pindah (terdelokalisasi). Gejala ini dinamakan resonansi.
resonansi1
Resonansi terjadi karena adanya delokalisasi elektron dari ikatan rangkap ke ikatan tunggal. Delokalisasi elektron yang terjadi pada benzena pada struktur resonansi adalah sebagai berikut:
resonansi2
Hal yang harus diperhatikan adalah, bahwa lambang resonasi bukan struktur nyata dari suatu senyawa, tetapi merupakan struktur khayalan. Sedangkan struktur nyatanya merupakan gabungan dari semua struktur resonansinya. Hal ini pun berlaku dalam struktur resonansi benzena, sehingga benzena lebih sering digambarkan sebagai berikut:
resonansi3
Teori resonansi dapat menerangkan mengapa benzena sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin karbonnya.
bagaimana jika dalam suatu senyawa C melahirkan gugus yang berbeda?
BalasHapus