hibridisasi
- Dapatkan link
- X
- Aplikasi Lainnya
Sebelum
membahas lebih lanjut tentang hibridisasi dan bagian-bagiannya, kita
terlebih dahulu mengetahui tentang sejarah dan pengertiannya. Teori
hibridisasi dipromosikan oleh kimiawan Linus Pauling dalam menjelaskan
struktur molekul seperti metana (CH4). Secara historis, konsep ini
dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan
ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap
sebagai sebuah heuristik yang efektif untuk merasionalkan struktur
senyawa organik.
Hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom
membentuk orbital hibrid yang baru yang sesuai dengan penjelasan
kualitatif sifat ikatan atom. Konsep orbital-orbital yang terhibridisasi
sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah
molekul.
Teori
hibridisasi sering digunakan dalam kimia organik, biasanya digunakan
untuk menjelaskan molekul yang terdiri dari atom C, N, dan O (kadang
kala juga P dan S). Penjelasannya dimulai dari bagaimana sebuah ikatan
terorganisasikan dalam metana.
Pembentukan ikatan dalam senyawa harus sesuai dengan aturan hibridisasi yaitu :
Pembentukan ikatan dalam senyawa harus sesuai dengan aturan hibridisasi yaitu :
- Orbital yang bergabung harus mempunyai tingkat energi sama atau hampir sama
- Orbital hybrid yang terbentuk sama banyaknya dengan orbital yang bergabung.
- Dalam hibridisasi yang bergabung adalah orbital bukan electron
- Salah satu electron yang berpasangan berpromosi ke orbital yang lebih tinggi tingkat energinya sehingga jumlah electron yang tidak berpasangan sama dengan jumlah ikatan yang akan terbentuk. Atom yang sedemikian disebut dalam keadaan tereksitasi. Promosi yang mungkin adalah dari ns ken p dan ns ke ns ke nd atau (n-1)d
- Penggabungan orbital mengakibatkan kerapatan electron lebih besar di daera orbital hybrid.
- Terjadi tumpang tindih orbital hybrid dengan orbital atom lain sehingga membentuk ikatan kovalen atau kovalen koordinasi.
Beberapa jenis hibridisasi orbital
Disini akan dijelaskan hibridisasi SP, SP2,SP3
1. Hibridisai SP
Salah satu contoh orbital sp terjadi pada Berilium diklorida.
Berilium mempunyai 4 orbital dan 2 elektron pada kulit terluar. Pada
hibridisasi Berilium dijelaskan bahwa orbital 2s dan satu orbital 2p
pada Be terhibridisasi menjadi 2 orbital hibrida sp dan orbital 2p yang
tidak tribridisasi. Hibridisasi sp membentuk geometri linear dengan sudut 180.
2. Hibridisasi sp2
Salah
satu contoh orbital hirbid sp2 diasumsikan terjadi pada Boron
trifluorida. Boron mempunyai 4 orbital tapi hanya 3 eletron pada kulit
terluar. Hibridisasi boron mengkombinasikan 2s dan 2 orbital 2p menjadi 3
orbital hybrid sp2 dan 1 orbital yang tidak mengalami hibridisasi.
Orbital hybrid sp2 menjadi bentuk trigonal planar dengan sudut
ikatan120.
3. Hibridisasi sp3
Hibridisasi satu orbital s dan tiga orbital p, membentuk orbital hibrida sp3 yang strukturnya tetrahedral. Sudut ikatan dengan orbital ini mendekati 109028’.
IKATAN RANGKAP TERKONJUGASI
Ikatan
rangkap terkonjugasi adalah ikatan antar atom yang terjadi pada senyawa
organik dan secara kovalen ikatan antar atomnya ialah ikatan rangkap
dua dan tunggal bergantian, dimana terjadi delokalisasi elektron agar
tingkat energinya lebih stabil. misalnya
pada ikatan C-C dan C-O tingkat kestabilan ikatan C-O lebih kuat karena
atom O akan menyumbangkan elektron kepada atom C sehingga
keelektronegatifan dan afinitas antar atom menjadi lebih kuat. Sistem
konjugasi secara umumnya akan menyebabkan delokalisasi elektron di
sepanjang orbital p yang paralel satu dengan sama lainnya. Hal ini akan
meningkatkan stabilitas dan menurunkan energi molekul secara
keseluruhan. Pengaturan kembali electron melalui orbital π, terutama
dalam system konjugasi atau senyawa organic yang atom-atomnya secara
kovalen berikatan tunggal dan ganda secara bergantian (C=C-C=C-C) dan
mempengaruhi satu sama lainnya membentuk daerah delokalisasi electron
disebut dengan konjugasi. Elektron-elektron pada daerah delokalisasi ini
bukanlah milik salah satu atom, melainkan milik keseluruhan system
konjugasi ini.
BENZENA DAN RESONANSI
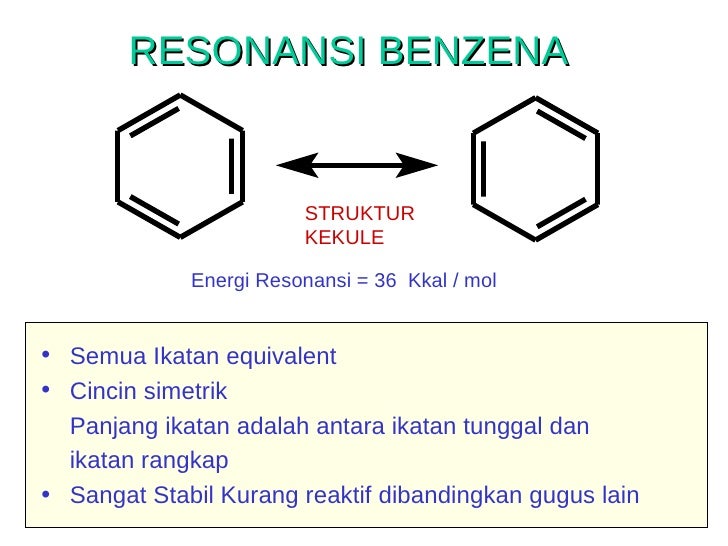
Benzena ialah suatu senyawa siklik yang elektronnya terkonjugasi. Benzena jika direaksikan dengan Br2 tidak dapat bereaksi.Benzena baru bisa dibrominasi dengan menggunakan asam lewis misalnya FeBr2.Mengapa direaksikan dengan katalis asam Lewis yakni dengan menggunakan FeBr3 sebagai katalis, karena dari teori, asam Lewis yang dapat membantu Br masuk kedalam ikatan benzena . Hal ini dikarenakan Fe dapat menyerap elektron ikatan pada benzene. Subtittuen yang terdapat dalam rantai siklo benzene dapat digolongkan sebagai pengarah orto, para, dan meta. Benzena yang mulanya telah tersubtitusi dapat mengalami subtitsi kedua dan menghasilkan disubtitusi benzene. Dari struktur subtitusi pertama ini dapat menentukan tempat dari subtitusi keduanya. Misalkan saja, dalam TNT (trinitrotoluene) pada cincin benzena terdapat suatu gugus metil yang mengarahkan subtitusi ke wilayah orto atau para. Sedangkan gugus nitro dapat mengarahkan subtitusi ke wilayah meta. Semua pengarah orto dan para merupakan pendonor elektron, yang dapat terjadi Karen resonansi maupun induksi. Pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena.

Benzena ialah suatu senyawa siklik yang elektronnya terkonjugasi. Benzena jika direaksikan dengan Br2 tidak dapat bereaksi.Benzena baru bisa dibrominasi dengan menggunakan asam lewis misalnya FeBr2.Mengapa direaksikan dengan katalis asam Lewis yakni dengan menggunakan FeBr3 sebagai katalis, karena dari teori, asam Lewis yang dapat membantu Br masuk kedalam ikatan benzena . Hal ini dikarenakan Fe dapat menyerap elektron ikatan pada benzene. Subtittuen yang terdapat dalam rantai siklo benzene dapat digolongkan sebagai pengarah orto, para, dan meta. Benzena yang mulanya telah tersubtitusi dapat mengalami subtitsi kedua dan menghasilkan disubtitusi benzene. Dari struktur subtitusi pertama ini dapat menentukan tempat dari subtitusi keduanya. Misalkan saja, dalam TNT (trinitrotoluene) pada cincin benzena terdapat suatu gugus metil yang mengarahkan subtitusi ke wilayah orto atau para. Sedangkan gugus nitro dapat mengarahkan subtitusi ke wilayah meta. Semua pengarah orto dan para merupakan pendonor elektron, yang dapat terjadi Karen resonansi maupun induksi. Pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena.
Permasalahan: apa yang menyebabkan jika benzena direaksikan dengan Br2 tidak dapat bereaksi?
- Dapatkan link
- X
- Aplikasi Lainnya





Berikan contoh hibridisasi sp2 ? Terima kasih.
BalasHapusKomentar ini telah dihapus oleh pengarang.
HapusSalah satu contoh orbital hirbid sp2 diasumsikan terjadi pada Boron trifluorida. Boron mempunyai 4 orbital tapi hanya 3 eletron pada kulit terluar. Hibridisasi boron mengkombinasikan 2s dan 2 orbital 2p menjadi 3 orbital hybrid sp2 dan 1 orbital yang tidak mengalami hibridisasi. Orbital hybrid sp2 menjadi bentuk trigonal planar dengan sudut ikatan120.
HapusSalah satu contoh orbital hirbid sp2 diasumsikan terjadi pada Boron trifluorida. Boron mempunyai 4 orbital tapi hanya 3 eletron pada kulit terluar. Hibridisasi boron mengkombinasikan 2s dan 2 orbital 2p menjadi 3 orbital hybrid sp2 dan 1 orbital yang tidak mengalami hibridisasi. Orbital hybrid sp2 menjadi bentuk trigonal planar dengan sudut ikatan120.
HapusSalah satu contoh orbital sp terjadi pada Berilium diklorida. Berilium mempunyai 4 orbital dan 2 elektron pada kulit terluar. Pada hibridisasi Berilium dijelaskan bahwa orbital 2s dan satu orbital 2p pada Be terhibridisasi menjadi 2 orbital hibrida sp dan orbital 2p yang tidak tribridisasi. Hibridisasi sp membentuk geometri linear dengan sudut 180.
HapusBerikan contoh hibridisasi sp2 ? Terima kasih.
BalasHapusKomentar ini telah dihapus oleh pengarang.
HapusSalah satu contoh orbital hirbid sp2 diasumsikan terjadi pada Boron trifluorida. Boron mempunyai 4 orbital tapi hanya 3 eletron pada kulit terluar. Hibridisasi boron mengkombinasikan 2s dan 2 orbital 2p menjadi 3 orbital hybrid sp2 dan 1 orbital yang tidak mengalami hibridisasi. Orbital hybrid sp2 menjadi bentuk trigonal planar dengan sudut ikatan120.
HapusSalah satu contoh orbital hirbid sp2 diasumsikan terjadi pada Boron trifluorida. Boron mempunyai 4 orbital tapi hanya 3 eletron pada kulit terluar. Hibridisasi boron mengkombinasikan 2s dan 2 orbital 2p menjadi 3 orbital hybrid sp2 dan 1 orbital yang tidak mengalami hibridisasi. Orbital hybrid sp2 menjadi bentuk trigonal planar dengan sudut ikatan120.
HapusSalah satu contoh orbital sp terjadi pada Berilium diklorida. Berilium mempunyai 4 orbital dan 2 elektron pada kulit terluar. Pada hibridisasi Berilium dijelaskan bahwa orbital 2s dan satu orbital 2p pada Be terhibridisasi menjadi 2 orbital hibrida sp dan orbital 2p yang tidak tribridisasi. Hibridisasi sp membentuk geometri linear dengan sudut 180.
HapusTolong berikan contoh dari hibridisasi sp3.
BalasHapusHibridisasi satu orbital s dan tiga orbital p, membentuk orbital hibrida sp3 yang strukturnya tetrahedral. Sudut ikatan dengan orbital ini mendekati 109028
HapusHibridisasi satu orbital s dan tiga orbital p, membentuk orbital hibrida sp3 yang strukturnya tetrahedral. Sudut ikatan dengan orbital ini mendekati 109028
Hapusjelaskan bagaimana terbentuknya orbital planar?
BalasHapusPenjelasannya dimulai dari bagaimana sebuah ikatan terorganisasikan dalam metana.
HapusPembentukan ikatan dalam senyawa harus sesuai dengan aturan hibridisasi yaitu :
1. Orbital yang bergabung harus mempunyai tingkat energi sama atau hampir sama
2. Orbital hybrid yang terbentuk sama banyaknya dengan orbital yang bergabung.
3. Dalam hibridisasi yang bergabung adalah orbital bukan electron
Penjelasannya dimulai dari bagaimana sebuah ikatan terorganisasikan dalam metana.
HapusPembentukan ikatan dalam senyawa harus sesuai dengan aturan hibridisasi yaitu :
1. Orbital yang bergabung harus mempunyai tingkat energi sama atau hampir sama
2. Orbital hybrid yang terbentuk sama banyaknya dengan orbital yang bergabung.
3. Dalam hibridisasi yang bergabung adalah orbital bukan electron